1、醫用植入物鈦及鈦合金標準化現狀
1.1 國外醫用植入物鈦及鈦合金標準化現狀
1.1.1 ISO標準
國際標準化組織外科植入物技術委員會(ISO/TC 150)負責制定永久或暫時性植入人體的醫療產品標準。ISO 外科植入物用材料標準為 ISO 5832 系列標準,現行有效的共計4項,見表1。該系列標準規定了材料的基礎特性,涵蓋組織成分、機械性能和顯微結構等內容。
表 1 ISO 醫用植入物鈦材標準
| 序號 | 標準編號 | 標準名稱 |
| 1 | ISO 5832-2/1999 | 外科植入物金屬材料 第 2 部分:純鈦加工材 |
| 2 | ISO 5832-3/1996 | 外科植入物金屬材料 第 3 部分:Ti-6Al-4V 合金加工材 |
| 3 | ISO 5832-11/2014 | 外科植入物金屬材料 第 11 部分:Ti-6Al-7Nb 合金加工材 |
| 4 | ISO 5832-14/ | 外科植入物金屬材料 第 14 部分:合金加工材 |
1.1.2 美國ASTM標準
美國材料與試驗協會制定的外科植入物用鈦標準共計 10 項,見表 2。在 ASTM 標準中,增加了第三代外科植入物用Ti-13Nb-13Zr等鈦合金標準,并針對鈦金屬鍛件、無縫管和粉末設立了專項標準,內容上增加了尺寸公差、表面污染層控制、無損檢測等關鍵要求。
表 2 美國 ASTM 醫用植入物鈦材標準
| 序號 | 標準編號 | 標準名稱 |
| 1 | ASTM F67-13 | 外科植入物用純鈦加工材 |
| 2 | ASTM F136-13 | 外科植入物用 Ti-6Al-4V ELI 合金加工材 |
| 3 | ASTM F620-15 | 外科植入物用 α+β 鈦合金鍛件 |
| 4 | ASTM F1295-11 | 外科植入物用 Ti-6Al-7Nb 合金加工材 |
| 5 | ASTM F1472-14 | 外科植入物用 Ti-6Al-4V 合金加工材 |
| 6 | ASTM F1580-12 | 外科植入物覆層用純鈦、Ti-6Al-4V 合金粉末 |
| 7 | ASTM F1713-08 | 外科植入物用 Ti-13Nb-13Zr 合金加工材 |
| 8 | ASTM F1813-13 | 外科植入物用 Ti-12Mo-6Zr-2Fe 合金加工材 |
| 9 | ASTM F2066-13 | 外科植入物用 Ti-15Mo 合金加工材 |
| 10 | ASTM F2146-13 | 外科植入物用 Ti-3Al-2.5V 無縫管 |
1.2 國內醫用植入物鈦及鈦合金標準化現狀
目前,我國醫用植入物用金屬材料相關國家標準共計 9 項,其中包含植入鈦材標準 3 項,規定了材料化學成分、機械性能、物理性能、性能測試方法等基礎要求。中國醫療器械行業標準化工作也在不斷完善,相繼制定了醫用植入物用金屬材料行業標準43項,其中包含植入鈦材標準9項,涉及牙科、骨科植入等方面材料和產品的標準要求,部分相關標準見表3。
表 3 我國醫用植入物鈦材標準(部分)
| 標準編號 | 標準類別 | 標準名稱 |
| GB/T 13810-2017 | 國家標準 | 外科植入物用鈦及鈦合金加工材 |
| GB/T 24627-2009 | 國家標準 | 外科植入物用鎳 - 鈦形狀記憶合金加工材 |
| GB 23102-2008 | 國家標準 | 外科植入物金屬材料 Ti-6Al-7Nb 合金加工材 |
| YY/T 1615-2018 | 行業標準 | 外科植入物鈦及鈦合金陽極氧化膜通用要求 |
| YY/T 1823-2022 | 行業標準 | 心血管植入物鎳鈦合金鎳離子釋放試驗方法 |
| YY 0315-2023 | 行業標準 | 鈦及鈦合金牙種植體 |
| YY/T 0512-2009 | 行業標準 | 外科植入物金屬材料 α+β 鈦合金棒材顯微組織的分類 |
| YY/T 1802-2021 | 行業標準 | 增材制造醫療產品 3D 打印鈦合金植入物金屬離子析出評價方法 |
1.3 國內外醫用植入物鈦及鈦合金標準化現狀對比總結
1.3.1 標準滯后于產品發展
GB/T 13810系列標準僅包含了第一代和第二代外科植入物用鈦加工材。對于我國生產的第三代外科植入物用鈦合金TC26和TB11,以及新研發的介入器械、植入產品,目前還未納入國家標準[1],且相關標準更新較慢。
1.3.2 標準內容不全面
目前,國內標準中的相關性能指標和技術要求與國外先進標準無明顯差異,但對于測試方法、加工工藝等技術標準仍需要進一步補充細化。另外,由于缺少完善的質量保證體系及產品配套工藝[2]
,生產過程中監督管理不到位的現象普遍存在。同時,現行標準在產品生物安全性評估方面不夠完善,可能存在安全隱患。
1.3.3 標準實施推廣力度較弱
目前,部分實施人員的技術能力尚未跟上行業技術的快速發展,標準化意識普遍不強。一些生產廠家對鈦合金材料標準和性能認識不足,導致植入物因材料原因發生斷裂失效,進而引起醫療糾紛。
2、醫用植入物鈦及鈦合金標準體系構建
2.1 醫用植入物鈦及鈦合金標準體系構建原則
根據GB/T 13016—2018《標準體系構建原則和要求》,醫用植入物鈦及鈦合金標準體系的構建應遵循目標明確、全面成套、層次適當、劃分清楚的原則。
2.2 醫用植入物鈦及鈦合金標準體系基本框架
基于標準體系構建原則和要求,結合我國現行醫用植入物鈦及鈦合金相關標準,搭建出我國醫用植入物鈦及鈦合金標準體系基本框架,如圖1所示。
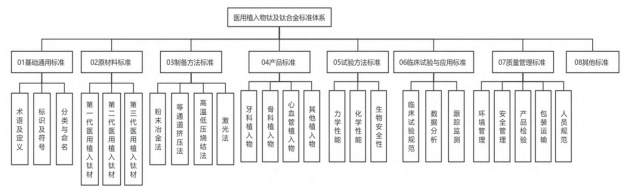
2.3 醫用植入物鈦及鈦合金標準體系構成要素
2.3.1 基礎通用標準體系
基礎通用標準為其他子系統提供基礎支撐,是醫用植入物鈦及鈦合金標準體系中重要的基礎共性規范,涵蓋的內容包括鈦及鈦合金、脊柱植入物、心血管和牙體植入物的術語定義、手術植入物的標識要求,以及外科植入物的分類與命名要求。
2.3.2 原材料標準體系
原材料標準細分為三代醫用植入鈦材,涵蓋了醫用植入物鈦及鈦合金標準體系中的原材料標準及其要求。第一代醫用植入鈦材是以 GB/T 13810—2017 為代表的外科植入物用鈦及鈦合金加工材標準。第二代醫用植入鈦材標準主要對材料的化學成分、機械性能、抗腐蝕性、生物相容性等方面提出了要求。這些標準幫助醫療器械制造商和使用者選擇合適的材料進行植入手術,同時確保病人長期健康。第三代醫用植入鈦材標準依據ISO 5832系列標準進行了進一步修訂,對表面處理和長期生物相容性的要求更加嚴格,使其能夠適應更復雜的植入需求,同時還加入了對新技術(如表面改性、涂層處理等)的規范,以確保植入物的長期使用效果和安全性。
2.3.3 制備方法標準體系
制備方法標準體系細分為粉末冶金法、等通道擠壓法、高溫低壓燒結法、激光法,主要包括醫用植入鈦材料生產加工過程中常用的幾種制備方法標準,有效保證產品制造質量。
2.3.4 產品標準體系
產品標準體系細分為牙科植入物、骨科植入物、心血管植入物和其他植入物,主要包括應用范圍較廣的鈦及鈦合金醫用植入物產品標準,其中有三項行業標準:YY/ T 0127.4—2023、YY/ T 0525—2009、YY/T 0127.8—2001,在牙科植入物相關產品標準中共同為牙科植入物和口腔材料的安全性和有效性提供了全面的生物學評價體系。骨科植入物標準涵蓋了從骨接合植入物、關節置換植入物、脊柱植入物到運動醫學植入器械等各個方面的要求,不僅確保了植入物的性能、安全性和生物相容性,還促進了技術的創新與個性化治療的實現。
2.3.5 試驗方法標準體系
試驗方法標準體系細分為力學性能、化學性能、生物安全性,主要包括醫用植入物材料性能測試方法標準,確保產品的可靠性和安全性。
2.3.6 臨床試驗與應用標準體系
臨床試驗與應用標準體系細分為臨床試驗規范、數據分析、跟蹤監測,主要包括鈦及鈦合金醫用植入物在臨床試驗和應用過程中的規范和要求。
2.3.7 質量管理標準體系
質量管理標準體系細分為環境管理、安全管理、產品檢驗、包裝運輸、人員規范。質量控制與檢驗是保障醫用植入物鈦及鈦合金質量的關鍵,有利于確保產品質量符合標準要求,提高產品質量和安全性。
對于外科植入物,尤其是如全髖關節假體這類需要長期與人體接觸的器械,其性能的可靠性和穩定性不僅依賴于材料的選擇和設計,還與試驗和儲存環境的控制密切相關。產品檢驗標準主要用于醫療器械質量體系軟件的確認。包裝和運輸標準用于確保醫療器械包裝的無菌安全性。
3、醫用植入物鈦及鈦合金標準體系實施建議
第一,應提高標準門檻,積極與 ISO、ASTM 等國際標準接軌,確保產品符合全球通用的質量要求。
第二,應完善相關標準,涵蓋原材料、生產工藝和質量控制等多個方面,尤其要修訂現有標準,細化技術指標,確保其適應實際使用需求。標準的制定應兼具約束性和開放性,既要確保產品的安全性,又要為技術進步預留空間。
第三,主管部門應加強標準的實施和監督,強化人才隊伍建設,定期開展標準宣貫和培訓工作,切實提高行業從業人員對標準的理解和執行能力。
第四,標準體系應保持動態優化,根據技術進步和臨床需求的變化及時進行修訂完善,確保標準的持續適用性和先進性。
4、結束語
標準化是國家創新發展的關鍵,推動標準體系建設能提高外科植入產品質量,增強其國際競爭力和市場影響力。因此,應結合國內產業水平,完善相關標準,推動新型材料的產業化和臨床應用,促進醫用植入物鈦材產業的健康發展。
參考文獻
[1] 譚瑩瑩.鈦基植入材料抗氧化功能界面的構建及其生物學評價[D].重慶:重慶大學,2022.
[2] 高景恒 . 關于醫用生物材料的安全性評價與評價標準[C]//吉林富華醫用高分子材料有限公司,實用美容整形外科雜志社.首屆國際醫用聚丙烯酰胺水凝膠:奧美定學術研討會論文集.遼寧省人民醫院,2000:125-135.
作者簡介
張保平,男,2003年出生,標準化工程專業本科在讀。
通信作者:陶姍,女,1980年出生,副教授,研究方向為工業標準化,taoshan@cjlu.edu.cn。
(注,原文標題:醫用植入物鈦及鈦合金標準體系構建研究)
相關鏈接
- 2023-11-02 3D打印鈦及鈦合金醫療器械的優勢及臨床應用研究
- 2023-02-07 我國鈦及鈦合金直縫焊管發展綜述
- 2023-02-06 TC4鈦合金棒熱矯直試驗工藝
- 2022-08-30 我市召開鈦及鈦合金產業鏈工作專題會議
- 2022-07-28 鈦及鈦合金用焊接材料標準與工藝方法標準概述
- 2021-12-28 船用TI31Ti75鈦合金裝備材料及制備技術研究進展概述
- 2021-12-21 鎳鈦絲鈦合金板在口腔正畸臨床中的應用
- 2021-10-06 鈦及鈦合金熱處理標準現狀及發展趨勢
- 2021-04-06 TC4Ti80鈦合金材料在海洋工程領域的應用現狀和發展趨勢
- 2021-03-21 我國鈦及鈦合金材料的應用現狀及發展趨勢

